最新考纲
1.掌握物质分离和提纯的方法。
2.能综合运用物质的不同性质对常见的物质进行分离和提纯。

1.物质分离和提纯的区别
(1)物质的分离
将混合物的各组分分离开来,获得几种纯净物的过程。
(2)物质的提纯
将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
2.物质分离和提纯的常用物理方法
试根据所学的知识填写操作方法及相关内容
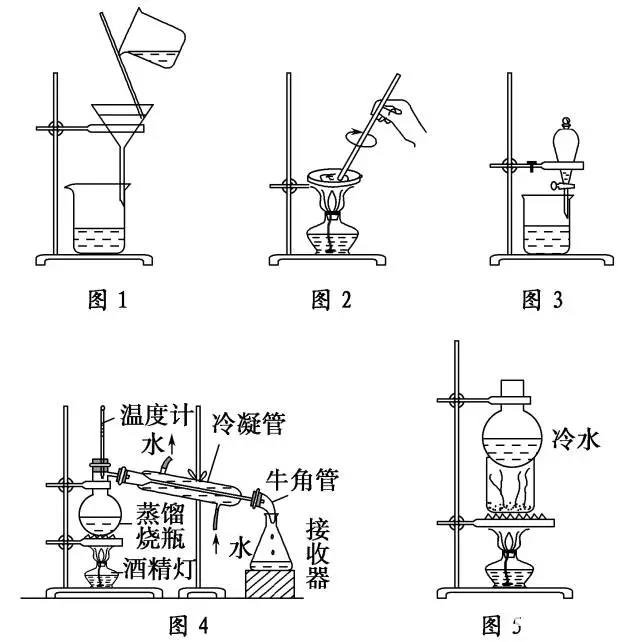
(1)如图1,方法、装置的名称:过滤。
适用范围:把不溶性固体与液体进行分离。
注意事项:
①一贴:滤纸紧贴漏斗内壁;
二低:滤纸上缘低于漏斗边缘,液面低于滤纸边缘;
三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。
②若滤液浑浊,需更换滤纸,重新过滤。浑浊的原因可能是滤纸破损、滤液超过滤纸边缘。
(2)结晶是晶体从饱和溶液中析出的过程,对溶解度受温度变化影响不大的固态溶质,采用蒸发溶剂的方法,而对溶解度受温度变化影响较大的固态溶质,采用冷却饱和溶液的方法。
如图2,方法、装置的名称:蒸发结晶。
适用范围:溶解度随温度变化较小的物质。
注意事项:
①玻璃棒的作用:搅拌,防止液体局部过热而飞溅;
②当有大量晶体析出时,停止加热,利用余热蒸干而不能直接蒸干。
(3)如图3,方法、装置的名称:分液。
适用范围:
①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;
②分液:两种液体互不相溶且易分层。
注意事项:
①溶质在萃取剂中的溶解度比在原溶剂中的大;
②萃取剂与原溶剂不反应、不相溶;
③萃取剂与溶质不反应;
④分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。
(4)如图4,方法、装置的名称:蒸馏。
适用范围:分离沸点相差较大的液体混合物
注意事项:
①温度计的水银球放在蒸馏烧瓶的支管口处;
②蒸馏烧瓶内要加沸石;③冷凝管水流方向应为“下口进,上口出”。
(5)如图5,方法、装置的名称:升华。
适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下使之分离的方法。
探究思考
1.在粗盐的提纯实验中,过滤,舍去不溶性杂质(滤渣)后,怎样从母液中获取NaCl固体?
答案 加热蒸发,当析出大量NaCl晶体时,停止加热,利用余热蒸干。
2.在常用方法和混合物之间连线。
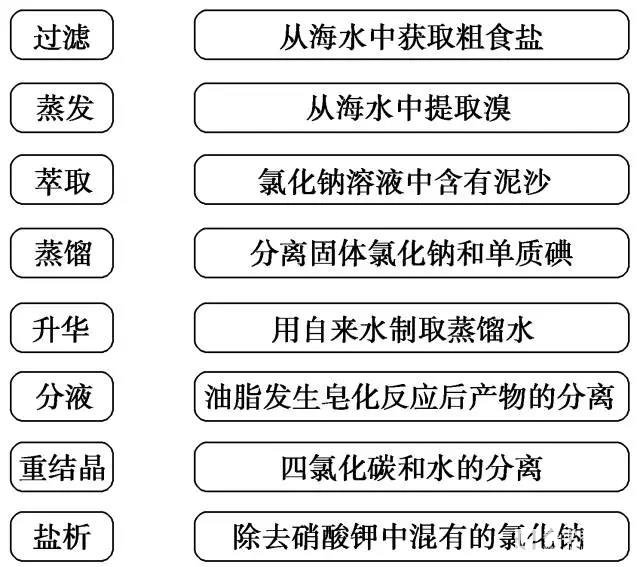
答案
不同状态混合物分离提纯的常用方法


5.含可溶性杂质的胶体的分离(提纯)
渗析法:用半透膜除去胶体中混有的小分子或离子等杂质。

- 学业水平系统测评
- 个性化一对一辅导计划
- 线下一对一试听课
- 系列学科辅导资料




- 热门课程
- 热门资讯
- 热门资料
- 热门福利
-
 高二化学怎么才能学好?学习化学应该注意哪些点?高二化学怎么才能学好?学习化学应该注意哪些点?学生们都知道,高中化学科目的知识点是十分杂乱的,学习起来压力很大,在课堂上上课的时候,需要我们去记各种笔记,积累各种小的知识点,把这些点都总结完之后,我们就会发现这些知识点其实都是环环相扣的,会形成一个巨大网状结构。当结构搭建起来以后,那么学习化学的
高二化学怎么才能学好?学习化学应该注意哪些点?高二化学怎么才能学好?学习化学应该注意哪些点?学生们都知道,高中化学科目的知识点是十分杂乱的,学习起来压力很大,在课堂上上课的时候,需要我们去记各种笔记,积累各种小的知识点,把这些点都总结完之后,我们就会发现这些知识点其实都是环环相扣的,会形成一个巨大网状结构。当结构搭建起来以后,那么学习化学的 -
 怎么才能学好高一年级物理科目,学习高一物理的方法有哪些?怎么才能学好高一年级物理科目,学习高一物理的方法有哪些?当学生从初中阶段进入高中的时候,高中学习的科目会有所增加,各科目的广度和深度也会有相应的增加。如果学习的思路和方法还停留在初中阶段,你就会感觉到在学习的过程中是非常吃力的,关键还是在于学习方法的变化。从初中到高中物理有了一个比较大的变化,因
怎么才能学好高一年级物理科目,学习高一物理的方法有哪些?怎么才能学好高一年级物理科目,学习高一物理的方法有哪些?当学生从初中阶段进入高中的时候,高中学习的科目会有所增加,各科目的广度和深度也会有相应的增加。如果学习的思路和方法还停留在初中阶段,你就会感觉到在学习的过程中是非常吃力的,关键还是在于学习方法的变化。从初中到高中物理有了一个比较大的变化,因 -
 初三学生如何进行总复习,有效的复习方法有哪些?初三学生如何进行总复习,有效的复习反复有哪些?初三上学期也接近了尾声,各科的教学也将陆续结束,那么在初三下学期将全面进入复习阶段。那么在课堂上老师会对重点的知识点进行归纳整理,系统地进行架构,来帮助同学们在脑海里形成一个完整的体系。在这个时候,就需要同学们能够集中精力,掌握课堂中的重点内容。那么
初三学生如何进行总复习,有效的复习方法有哪些?初三学生如何进行总复习,有效的复习反复有哪些?初三上学期也接近了尾声,各科的教学也将陆续结束,那么在初三下学期将全面进入复习阶段。那么在课堂上老师会对重点的知识点进行归纳整理,系统地进行架构,来帮助同学们在脑海里形成一个完整的体系。在这个时候,就需要同学们能够集中精力,掌握课堂中的重点内容。那么 -
 孩子初三英语成绩比较差怎么办?初三英语有效的学习方法有哪些?孩子初三英语成绩比较差真么办,初三英语有效的学习方法有哪些?初中的英语是一个极为重要的学习过程,是非常重要的基础阶段。所以英语的学习不能只注重结果,而是更应看重过程。如果只是为了应付考试,不利于长久的英语学习。那么学习英语是一个积累的过程,只有你的词汇量不断变得丰富,语法和语感越来越娴熟,才能学
孩子初三英语成绩比较差怎么办?初三英语有效的学习方法有哪些?孩子初三英语成绩比较差真么办,初三英语有效的学习方法有哪些?初中的英语是一个极为重要的学习过程,是非常重要的基础阶段。所以英语的学习不能只注重结果,而是更应看重过程。如果只是为了应付考试,不利于长久的英语学习。那么学习英语是一个积累的过程,只有你的词汇量不断变得丰富,语法和语感越来越娴熟,才能学
-
 2020年11月全国百强名校领军考试试题2020年11月全国百强名校领军考试试题!各位学生注意了,全国百强名校的试题大家做过吗?最近很多地方都进行了大考,大家一定要收集研究这些考试资料。为方便各位学生了解参考,秦学教育陕西伊顿名师辅导老师第一时间为大家整理了11月全国百强名校领军考试试题,想要了解的学生快看! 附:1
2020年11月全国百强名校领军考试试题2020年11月全国百强名校领军考试试题!各位学生注意了,全国百强名校的试题大家做过吗?最近很多地方都进行了大考,大家一定要收集研究这些考试资料。为方便各位学生了解参考,秦学教育陕西伊顿名师辅导老师第一时间为大家整理了11月全国百强名校领军考试试题,想要了解的学生快看! 附:1 -
 2020年11月全国百强名校领军考试答案2020年11月全国百强名校领军考试答案!各位学生注意了,最近是各个学校的模拟大考时间,大家都经历了哪些大型考试呢?全国百强名校联考大家知道吗?为方便各位学生了解参考,秦学教育陕西伊顿名师老师第一时间为大家整理了11月全国百强名校领军考试答案,想要了解的学生快看!更多有关免费资料信息,欢迎
2020年11月全国百强名校领军考试答案2020年11月全国百强名校领军考试答案!各位学生注意了,最近是各个学校的模拟大考时间,大家都经历了哪些大型考试呢?全国百强名校联考大家知道吗?为方便各位学生了解参考,秦学教育陕西伊顿名师老师第一时间为大家整理了11月全国百强名校领军考试答案,想要了解的学生快看!更多有关免费资料信息,欢迎 -
 陕西2021届高三第二次联考物理试卷答案解析!物理辅导班怎么选?高中阶段的物理学习对于大部分学生来说都是难度最大的一科,从高一开始就有学生因为物理太难,之后的选科直接放弃物理,选择了物理的高中生在之后的学习中会发现难度越来越大,学起来越来越困难,这时候选择一家口碑好效果好的物理辅导班非常重要,伊顿名师高中物理补习班很符合大家的需求!下面还有小编为大家整理的陕
陕西2021届高三第二次联考物理试卷答案解析!物理辅导班怎么选?高中阶段的物理学习对于大部分学生来说都是难度最大的一科,从高一开始就有学生因为物理太难,之后的选科直接放弃物理,选择了物理的高中生在之后的学习中会发现难度越来越大,学起来越来越困难,这时候选择一家口碑好效果好的物理辅导班非常重要,伊顿名师高中物理补习班很符合大家的需求!下面还有小编为大家整理的陕 -
 陕西高三补习学校哪家好?附2021陕西高三第二次联考文数答案!高三学生们选择校外的全日制补习学校作用大不大?对于那些学习努力成绩不见提升,以及学习自觉性差成绩起伏大,还有偏科现象严重的高三学生们来说,高三全日制补习学校是有很多好处的。陕西省哪家高三补习学校口碑好?口碑和师资都是选择学校的关键因素,还有就是升学率等等,为大家推荐伊顿名师补习学校!小编还为大家
陕西高三补习学校哪家好?附2021陕西高三第二次联考文数答案!高三学生们选择校外的全日制补习学校作用大不大?对于那些学习努力成绩不见提升,以及学习自觉性差成绩起伏大,还有偏科现象严重的高三学生们来说,高三全日制补习学校是有很多好处的。陕西省哪家高三补习学校口碑好?口碑和师资都是选择学校的关键因素,还有就是升学率等等,为大家推荐伊顿名师补习学校!小编还为大家

- 陕西
- 浙江
- 江苏
- 广西
- 云南
- 四川
- 内蒙
- 西安航天城校区
- 西安经开校区
- 太乙路校区
- 金堆城校区
- 西安逸翠园校区
- 经开校区
- 榆林七中校区
- 西安城西校区
- 渭南信达校区
- 宝鸡高新班组校区
- 西安小寨校区
- 西安明德校区
- 安康汉滨中学
- 宝鸡高新校区
- 宝鸡渭滨校区
- 宝鸡金台1对1校区
- 宝鸡清姜校区
- 宝鸡金台班组校区
- 西安高新校区
- 西安阎良校区
- 商洛校区
- 延安中学校区
- 延安实验中学
- 榆林东沙校区
- 榆林高新校区
- 榆林二街
- 汉中汉台校区
- 咸阳中宏校区
- 安康中学校区
- 渭南瑞泉中学校区
- 渭南渭高校区
- 渭南新洲校区
- 咸阳陕科大
- 咸阳实验中学
- 西安临潼铁中校区
- 西安爱知中学校区
- 西安马家湾校区
- 西安交大校区
- 西安黄河中学校区
- 西安市第一中学校区
- 西安高级中学校区
- 西安中学校区
- 西安85中校区
- 西安土门校区















